L’utilizzo dei coloranti alimentari è tuttora ammesso nei medicinali, senza alcuna valutazione dei rischi specifici legati alle vulnerabilità e patologie dei soggetti a cui essi sono destinati.
Le compresse di farmaci che dovrebbero trattare disturbi intestinali possono così venire rese ‘splendenti’ con il biossido di titanio, il quale ‘induce modificazioni nel colon e nel retto che possono evolvere, nel tempo, in cancro’. (1)
La proposta di riforma della Medicines Directive 2001/83/CE tuttavia – anziché rafforzare la tutela dei consumatori più vulnerabili, in quanto costretti ad assumere farmaci – estende le deroghe a favore di Big Pharma. (2)
1) Coloranti alimentari, nozione
Food Colors Regulation (EC) No 1333/2008 definisce i coloranti alimentari come ‘sostanze che conferiscono un colore a un alimento o ne restituiscono la colorazione originaria, e includono componenti naturali degli alimenti e altri elementi di origine naturale, normalmente non consumati come alimento né usati come ingrediente tipico degli alimenti.
Sono coloranti […] le preparazioni ottenute da alimenti e altri materiali commestibili di base di origine naturale ricavati mediante procedimento fisico e/o chimico che comporti l’estrazione selettiva dei pigmenti in relazione ai loro componenti nutritivi o aromatici’. (3)
Gli alimenti e i loro estratti, allorché utilizzati per colorare gli alimenti, possono venire classificati come alimenti coloranti (coloring foods) o coloranti alimentari (colors), in base alla selettività di estrazione delle sostanze responsabili della colorazione. Con attenzione a verificare preliminarmente che la matrice alimentare non si qualifichi come novel food. (4)
2) Sicurezza alimentare
La sicurezza di tutti gli ingredienti alimentari, ivi inclusi gli additivi nel cui ambito si collocano i coloranti, costituisce un pre-requisito per la loro immissione nel mercato unico europeo (General Food Law, Reg. CE No 178/02, articolo 14). Dalla teoria alla pratica, numerosi additivi alimentari sono causa di preoccupazione a causa di rischi di salute pubblica che la Commissione europea ha finora gestito con parzialità e anni di ritardo.
Gli esempi non mancano, dal cancerogeno biossido di titanio – il cui impiego è tuttora ammesso nei farmaci e i dentifrici, nonostante i rischi anche specifici identificati in letteratura (5) – ai coloranti azoici (Southampton colors). Sostanze ampiamente utilizzate, nel corso dei decenni, su alimenti (e medicinali) destinati anche alle fasce di popolazione più vulnerabili (neonati, bambini, donne in gravidanza, anziani). (6)
3) Coloranti alimentari nei medicinali. Sicurezza e ‘trasparenza’ in etichetta
L’utilizzo dei coloranti alimentari autorizzati nei medicinali e medicinali veterinari è tuttora disciplinato dalla direttiva 2009/35/EC che li considera sicuri perciò soltanto, a prescindere dalle vulnerabilità specifiche della ‘popolazione target’ a cui i farmaci sono destinati. (7) Le uniche prescrizioni contenute nella direttiva riguardano infatti:
– l’impiego dei soli coloranti alimentari autorizzati, contenuti nell’elenco positivo degli additivi alimentari in UE; (8)
– il rispetto delle specifiche generali, per i pigmenti coloranti di alluminio, e quelle specifiche previste per i singoli coloranti alimentari; (9)
– la previsione di un periodo transitorio per la commercializzazione di prodotti che contengano additivi alimentari esclusi dall’elenco delle sostanze autorizzate. Con alcune deplorevoli deroghe introdotte dalla Commissione, per i medicinali, nei casi di biossido di titanio e cantaxantina. (10)
La trasparenza in etichetta dei medicinali per uso umano viene inoltre negata ex-lege, laddove la Medicines Directive 2001/83/CE non prescrive l’indicazione esatta degli ‘additivi coloranti’. Limitandosi a inquadrare tali sostanze nell’ampia quanto opaca categoria degli ‘eccipienti’, al pari di tutte le componenti dei farmaci diverse dalla ‘sostanza attiva’ (i.e. il principio attivo nel medicinale) e dal materiale di imballaggio.
4) Coloranti utilizzati nei medicinali, giustificazioni d’uso e valutazione dei rischi
La giustificazione teorica per ammettere l’impiego dei coloranti nei medicinali è ‘aiutare i pazienti a distinguere i diversi medicinali’. Senza indugiare sulla funzione essenziale di marketing, volta a incrementare l’attrattività del prodotto, la quale:
– non giustifica di per sé l’introduzione di sostanze potenzialmente pericolose per la salute dei soggetti a cui i farmaci sono rivolti, e
– merita apposite valutazioni del rischio, le quali tuttavia sono ancora affidate ad apposite linee guida di EMA (European Medicines Agency).
Tutti gli eccipienti utilizzati nella formulazione e produzione di medicinali, ivi inclusi i coloranti, dovrebbero infatti venire utilizzati tenendo in considerazione anche la popolazione target di riferimento (i.e. bambini, anziani) e i possibili effetti avversi. Le apposite linee guida di EMA dovrebbero quindi venire seguite sia sui medicinali da autorizzare, sia per modifiche di medicinali già autorizzati, sia in fase di ricerca clinica dello sviluppo del farmaco (11,12). La loro concreta applicazione può peraltro venire (fortemente) dubitata, leggendo la composizione di numerosi medicinali e integratori alimentari autorizzati in UE.
5) Utilizzi e classificazioni
Gli utilizzi dei coloranti nei medicinali sono molteplici in compresse, capsule e gli sciroppi. Le principali distinzioni riguardano:
– solubilità. Tinture (dyes), solubili in acqua, e pigmenti (pigments), insolubili in acqua;
– origine. Naturale o di sintesi. (13)
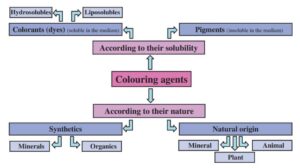
Un’opaca classificazione dei coloranti utilizzati nei medicinali distingue:
1) tinture organiche e relative lacche (lakes, derivato da lac, ottenuta dagli insetti). A dispetto del nome, questa categoria comprende anche i coloranti di origine sintetica (i.e. coloranti azoici), i quali hanno un elevato potere colorante e sono più economici di quelli naturali. A differenza delle lacche naturali, che vengono impiegate in dispersione poiché insolubili, essi vengono usati principalmente in forma di sali solubili in acqua;
2) colori inorganici o minerali. Presentano una buona stabilità alla luce e in alcuni casi sono opachi, come il famigerato biossido di titanio o gli ossidi di ferro (gialli e rossi);
3) colori naturali, o colori vegetali e animali. Possono venire ottenuti per estrazione da piante, alberi o animali, o ottenuti per via di sintesi. I primi sono generalmente meno stabili a luce, calore e determinati range di pH. Tra questi si segnalano il caramello, annatto, curcumina, riboflavina, antocianina e il rosso cocciniglia (considerato tra i più pericolosi, per via del carminio in grado di causare reazioni allergiche, tumore alla pelle e iperattività nei bambini, e.g. ADD e ADHD).
6) Medicines Directive, proposta di riforma
Big Pharma non ha permesso che la riforma dei medicinali – al pari di quella dei farmaci veterinari, messa a punto nel 2020 – venisse attuata sotto forma di regolamenti, vale a dire regole identiche da applicarsi contestualmente in Unione Europea. La riforma dell’ormai obsoleta Medicines Directive 2001/83/CE passerà quindi per una nuova direttiva, la quale verrà recepita nei 27 Stati membri con le consuete variazioni, a livello nazionale, che sono causa strutturale di asimmetrie di tutela dei consumatori e ostacoli alla libera circolazione delle merci nel mercato interno.
6.1) Coloranti nei medicinali, nessuna maggior tutela
Il progetto di riforma, adottato a Bruxelles il 26.4.23 e tuttora all’esame della Commissione ENVI (Environment, Public Health and Food Safety) del Parlamento europeo, (14) nella parte relativa ai coloranti:
– conferma la possibilità di utilizzare nei farmaci per uso umano i coloranti già autorizzati per l’uso alimentare, senza introdurre alcuna maggior tutela per fasce specifiche di popolazione né per quelle soggette a patologie e vulnerabilità specifiche a cui i medicinali siano perciò destinati,
– introduce un nuovo elenco di coloranti esclusi dalla lista degli additivi alimentari e tuttavia autorizzati all’impiego esclusivo nei farmaci, previo eventuale parere di EMA, anche in attesa di decisione della Commissione che dovrà comunque considerare l’opinione di EFSA (European Food Safety Authority).
7) Conclusioni provvisorie
La lobby farmaceutica vince a mani basse, ancora una volta, come facile a prevedersi. In un’Europa ove – è bene ricordare – né la presidente Ursula con der Leyen né la Commissaria europea per la Sicurezza alimentare e la Salute pubblica Stella Kyriakides hanno saputo offrire spiegazioni credibili su come 4 milioni di euro siano ‘piovuti’ sul conto del marito di quest’ultima, che gli storici ricorderanno come la ‘Commissaria dei vaccini’. (15) I cui contratti sono stati negoziati in nome dell’Unione Europea da Sandra Gallina, direttrice generale della DG Sante la quale – come ha ricordato Roberto Burioni – ‘è laureata alla scuola interpreti e ha avuto a che fare per la prima volta con la sanità nel luglio 2020’. (16)
#ProfitsOverPeople, fino a quando?
Dario Dongo e Andrea Adelmo Della Penna
Note
(1) Marta Strinati. Stop al biossido di titanio, intervista a Francesco Cubadda, esperto ISS. GIFT (Great Italian Food Trade). 8.5.21
(2) Proposal for a directive of the European Parliament and of the Council on the Union code relating to medicinal products for human use, and repealing Directive 2001/83/EC and Directive 2009/35/EC (COM/2023/192 final) http://tinyurl.com/yx36jut8
(3) Reg. (EC) No 1333/2008, Allegato I, punto 2
(4) Dario Dongo, Andrea Adelmo Della Penna. Alimenti coloranti e loro estratti. Ingredienti o additivi? GIFT (Great Italian Food Trade). 24.12.22
(5) Marta Strinati. Nuovo studio sui rischi del biossido di titanio presente in dentifrici e farmaci. GIFT (Great Italian Food Trade). 20.8.23
(6) Marta Strinati. Il ruolo degli alimenti ultraprocessati nelle malattie infiammatorie intestinali. GIFT (Great Italian Food Trade). 15.11.22
(7) Directive 2009/35/EC on the colouring matters which may be added to medicinal products (recast) http://tinyurl.com/mpnk5p2w
(8) Reg. (EC) No 1333/2008, Allegato II, parte B, punto 1
(9) Le specifiche sono riportate nel Reg. (EU) No 231/2012. La direttiva 81/716/CEE, che definiva i metodi di analisi per il controllo dei criteri di purezza di alcuni additivi alimentari, tra cui i coloranti, è stata abrogata dal Reg. (EC) No 1333/2008.
(10) Reg. (EU) No 1129/2011 riporta che tale colorante (E 161g) è stato autorizzato solamente nelle saucisses de Strasbourg, e successivamente non più impiegato. La sua presenza nell’elenco positivo dei coloranti alimentari sussiste esclusivamente per il suo utilizzo nei medicinali ad uso umano e veterinario (recital 14)
(11) EMA Committee for Medicinal Products for Human Use, CMPH. (2007). Guideline on excipients in the dossier for application for marketing authorisation of a medicinal product. EMEA/CHMP/QWP/396951/2006 http://tinyurl.com/yc3dyhas
(12) EMA Committee for Veterinary Medicinal Products, CVMP. (2023). Guideline on excipients in the dossier for application for marketing authorisation for veterinary medicinal products (EMA/CVMP/QWP/307647/2023) http://tinyurl.com/4h8ecbcx
(13) Šuleková M. et al. (2017) Organic Colouring Agents in the Pharmaceutical Industry. Folia Veterinaria 61(3):32-46, https://doi.org/10.1515/fv-2017-0025
(14) La riforma prevede una completa revisione della normativa sui medicinali per uso umano che include, in una proposta separata (COM(2023) 193 final), un nuovo regolamento che aggiorna i requisiti per l’autorizzazione e la sorveglianza dei medicinali e incorpora diverse categorie di medicinali finora regolate con provvedimenti separati (e.g. medicinali orfani, medicinali per uso pediatrico)
(15) Dario Dongo. 4 milioni di euro piovuti sul conto della Commissaria europea dei vaccini. Égalité. 16.5.21
(16) Si veda la nota 14 al precedente articolo di Dario Dongo. Integratori alimentari con estratti di curcuma, possibili rischi di salute. GIFT (Great Italian Food Trade). 24.8.22






