Il microbiota intestinale – vale a dire, la comunità di microrganismi che abita e interagisce con il ‘secondo cervello’ – influenza lo sviluppo e l’omeostasi del sistema immunitario dei mammiferi. Una funzione cruciale colpevolmente trascurata in 9 mesi di dibattiti televisivi e mediatici su Covid-19, a dispetto delle raccomandazioni che il premio Nobel Luc Montagnier formulò già prima della dichiarazione di pandemia da parte dell’ONU.
La concentrazione e varietà delle specie batteriche del microbiota (un tempo noto come ‘flora batterica’) contribuiscono perciò a prevenire infiammazioni e malattie immunitarie. Il suo squilibrio, viceversa, comporta maggiore vulnerabilità a numerose patologie. La dieta si riconferma essere la prima medicina, secondo la scuola di Ippocrate. Gli interventi focalizzati sul microbioma appaiono altresì promettenti nella gestione e terapia di alcune patologie cronico-degenerative.
Eredità materna
L’acquisizione del patrimonio microbico intestinale avviene alla nascita, durante la separazione dalla madre. Le modalità di parto, naturale e cesareo, influenzano tra l’altro lo status e composizione del microbiota. La diversità, da principio maggiore in caso di parto naturale, è comunque instabile e va a implementarsi nei primi anni di vita. (1)
La variabilità individuale del microbiota intestinale rimane elevata. Tende a stabilizzarsi in età adulta, fino a raggiungere una variabile capacità di resilienza alle avversità (es. dieta, trattamento con antibiotici) e al trascorrere dell’età. (2) E a diminuire nella terza età, con l’immunosenescenza.
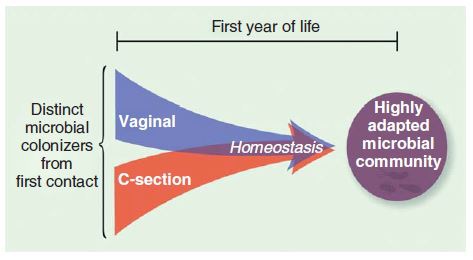
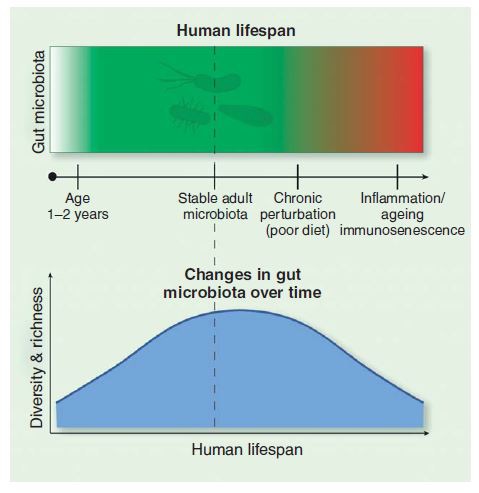
Fig. 1 e 2. Formazione del microbiota nel primo anno di vita, suo sviluppo e cambiamento nel corso del tempo (Peterson et al., 2014)
Microbioma e microbiota
I due termini microbioma e microbiota vengono utilizzati spesso come sinonimi, ma in realtà il significato è diverso. Nel primo caso si riferisce al genoma della popolazione batterica che colonizza differentemente il tratto intestinale (crescente verso la parte distale), la quale costituisce il microbiota vero e proprio. (3)
La dimensione del microbioma è molto ampia, approssimativamente pari a 150 volte il genoma umano. Grazie alle nuove tecnologie di sequenziamento (tra le quali il gene 16S del DNA ribosomiale) è oggi possibile identificare meglio le specie dei phyla Firmicutes e Bacteroidetes (circa il 92% del microbiota intestinale), le quali differiscono in ciascun individuo per via di fattori genetici ed ambientali. (4)
Immunità innata e adattativa
Il sistema immunitario innato produce segnali, verso l’ospite, che possono influenzare la composizione e la funzione del microbiota intestinale. Può favorire lo sviluppo dei microrganismi benefici e contribuire al mantenimento di una popolazione equilibrata, ovvero il contrario. Il microbiota in ogni caso aiuta il sistema immunitario innato a difendere l’invasione intestinale da microrganismi patogeni (resistenza della colonizzazione). (5)
La composizione del microbiota intestinale è inoltre capace di influenzare il sistema immunitario adattativo. In base alla nicchia microbica, agli antigeni e ai metaboliti da essi prodotti, si ha un intervento sulle cellule B, le cellule T e sulle citochine che determinano le risposte pro-infiammatorie e immunitarie. In caso di una mancata omeostasi del sistema adattativo con il microbiota, la suscettibilità a diverse patologie può aumentare dentro e fuori l’intestino. (6)
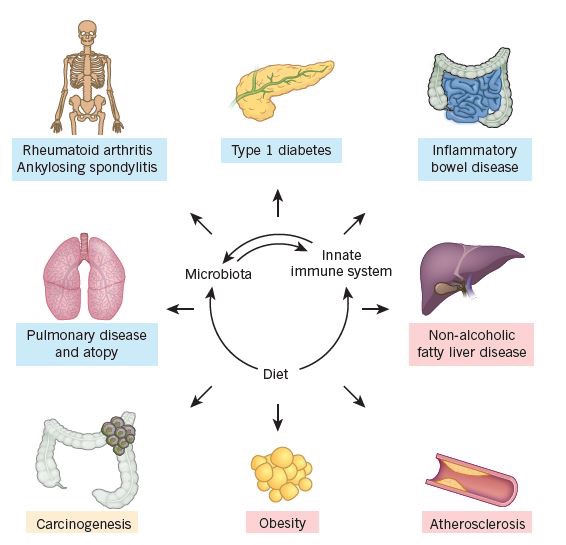
Fig. 3. Malattie dovute a disordini infiammatori instaurati da alterazioni del crosstalk tra microbiota e sistema immunitario, influenzati dalla dieta (Thaiss et al., 2016)
Disbiosi intestinale e patologie
La disbiosi ha un impatto importante sulla salute, poiché diverse patologie sono correlate proprio con un’alterazione del microbiota. L’infiammazione intestinale porta alla “fioritura” di patogeni che normalmente sono una nicchia, ma l’effetto di contenimento dei commensali benefici permette di aumentare il loro numero, portando alla formazione dell’ “inflammabioma” (adattamento e risposta di batteri in un intestino infiammato) (7)
I batteri commensali possono indurre risposte infiammatorie dovute dall’alterazione del metabolismo lipidico e portare all’aterosclerosi. Tra i principali responsabili, i lipopolisaccaridi (LPS) presenti sulla superficie dei batteri avviano questo meccanismo e sono legati a malattie come diabete e obesità. Però ci sono altre molecole pro-infiammatorie (es. peptidoglicano) che hanno azione battericida contro patogeni come Streptococcus pneumoniae e Staphylococcus aureus. (8)
Altre patologie da disbiosi
Altre patologie che possono essere indotte dallo stato di disbiosi riguardano:
Cuore e reni. La perdita di integrità della barriera intestinale, la permeabilità dei patogeni e dei loro metaboliti tossici portano alla rottura dell’equilibrio ospite-microbiota e allo sviluppo di patologie cardiovascolari e croniche dei reni. (9)
Malattia di Chron e colite ulcerosa. Fanno parte delle malattie infiammatorie intestinali e sono dovute da un’eccessiva mobilitazione dei batteri nella parete intestinale e dalla difficoltà a mantenere integra la barriera intestinale, co-responsabile delle difese immunitarie intestinali (10)
Dieta e microbiota
La dieta, come si è visto, è l’intervento più efficace per garantire la buona salute del microbiota e correggere eventuali irregolarità. Un’alimentazione squilibrata viceversa – nel nutrire i batteri dannosi e/o limitare concentrazione e varietà di quelli amici – può indurre la disbiosi e favorire lo sviluppo di diverse patologie. (11)
La ricerca scientifica ha mostrato numerose correlazioni tra gli apporti di nutrienti (es. Omega 3, fibre alimentari), micronutrienti, fitocomplessi (es. polifenoli) e il miglioramento dello stato di salute del microbiota. Con conseguente rafforzamento del sistema immunitario. Per approfondire il tema si richiama il Volume I – Persone della nostra trilogia ‘Covid-19, l’ABC’, su https://www.greatitalianfoodtrade.it/covid-19-abc-volume-i-persone_1.
Terapie
Negli ultimi anni, il trapianto fecale del microbiota si è rivelato essere una tecnica molto promettente per il trattamento di alcune malattie, intestinali e non. Il microbiota viene fornito da un donatore, spesso membro della famiglia. Il suo trapianto ha un’elevata percentuale di successo, in linea generale, per ridurre la disbiosi. (12)
L’antibiotico-resistenza, tra l’altro, può riguardare anche le specie patogene del microbiota intestinale. Si è perciò resa necessaria la ricerca di modalità alternative per l’eliminazione dei patogeni. E l’utilizzo dei batteriofagi, virus specializzati nell’uccisione dei batteri, è risultata promettente per via della loro precisione d’azione, che permette di non danneggiare i batteri commensali benefici. (13)

Fig. 4. Interventi correttivi della disbiosi tramite dieta o modifica del microbiota (Rizzetto et al., 2020)
Dario Dongo e Andrea Adelmo Della Penna
Note
(1) Peterson et al. (2014). Immune homeostasis, dysbiosis and therapeutic modulation of the gut microbiota. Clinical and Experimental Immunology 179:363-377, doi:10.1111/cei.12474
(2) Lozupone et al. (2012). Diversity, stability and resilience of the human gut microbiota. Nature 489:220-230, doi: 10.1038/nature11550
(3) Ursell et al. (2012). Defining the human microbiome. Nutrition Reviews 70(1):S38-44, doi:10.1111/j.1753-4887.2012.00493.x
(4) Shi et al. (2017.) Interaction between the gut microbiome and mucosal immune system. Military Medical Research 4:14, doi: 10.1186/s40779-017-0122-9
(5) Thaiss et al. (2016). The microbiome and innate immunity. Nature 535:65-74, doi:10.1038/nature18847
(6) Zhao et al. (2018). Adaptive immune education by gut microbiota antigens. Immunology 154:28-37, doi:10.1111/imm.12896
(7) Stecher (2015). The roles of inflammation, nutrient availability and the commensal microbiota in enteric pathogen infection. Microbiology Spectrum 3(3), doi: 10.1128/microbiolspec.MBP-0008-2014
(8) Christiakov et al. (2015). Role of gut microbiota in the modulation of atherosclerosis-associated immune response. Frontiers in Microbiology 6:671, doi:10.3389/fmicb.2015.00671
(9) Suganya et al. (2020). Impact of gut microbiota: How it could play roles beyond the digestive system on development of cardiovascular and renal diseases. Microbial Pathogenesis 104583, https://doi.org/10.1016/j.micpath.2020.104583
(10) Becker et al. (2015). The intestinal microbiota in inflammatory bowel disease. ILAR Journal 56(2):192-204, doi:10.1093/ilar/ilv030
(11) Rizzetto et al. (2018). Connecting the immune system, systemic chronic inflammation and the gut microbiome: The role of sex. Journal of Autoimmunity 92:12-34, https://doi.org/10.1016/j.jaut.2018.05.008
(12) Yeh et al. (2020). Mutual interplay of host immune system and gut microbiota in the immunopathology of atherosclerosis. International Journal of Molecular Sciences 21:8729, doi:10.3390/ijms21228729
(13) Vujkovic-Cvijin et al. (2019). HIV and the gut microbiota: composition, consequences, and avenues for amelioration. Current HIV/AIDS Report 16(3):204-213, doi:10.1007/s11904-019-00441-w